更新 2024-3-3
クラスレート(Clathrate)
固体結晶の多くは原子の最密充填から派生した結晶構造を持ちます.すなわち、原子が可能な限り密に詰まることで安定した結晶を形作ります.これは、固体結晶で支配的な化学結合が等方的な金属結合とイオン結合であることによります.結合が等方的であれば、一つの原子に結合する原子の数は多ければ多いほど好ましく、それゆえ結合する原子の数が最多である最密充填構造が安定化されます.
最密充填構造は合理的ですが、有機化学で見られる多種多様な分子構造と比べるとやや地味で面白みに欠けます.有機化学では、炭素と炭素からなるネットワークを駆使して、蜂の巣型、正方形型、サッカーボール型まで多種多様な構造を持ちます.有機化学に比べると、一見しただけで非専門家にも「面白そう」と思ってもらえるような構造は無機結晶には少なめです.
有機化学でなぜ多様な構造ができるのかといえば、炭素が方向性を持った共有結合を形成するためであると考えられます.炭素がネットワークを形作り、水素で「ふた」をすることで美しい構造が完成します.共有結合は有機化学の専売特許ではないので、無機結晶でも共有結合をうまく使えば原子の美しいネットワークを形成することができるはずです.
今回紹介するクラスレートは、結晶内のシリコンによって形成される「カゴ型」のネットワークを持ちます.「カゴ」の種類、示す物性ともに豊富で、基礎的・応用的にも大いに期待されている物質群です.
- クラスレート(Clathrate)
- クラスレート(Clathrate)の発見
- クラスレート(Clathrate)の結晶構造
- クラスレートの人工合成
- クラスレート(Clathrate)の機能
- まとめ
- 参考文献
クラスレート(Clathrate)の発見
2種類以上の原子(または分子)が結晶を形成する際に、一方がホストとなって様々な多面体を含んだ三次元的な骨格構造を形成し、もう一方がゲストとしてその骨格に内包されたような結晶構造を持つ物質をクラスレート(Clathrate)と呼びます.ゲストは大きな多面体カゴの中で孤立しており、ホストとは明確な化学結合を持ちません.
クラスレートとは聞き慣れない言葉ですが、ラテン語で格子を意味するclathriと、「横木に守られた」という意味のclathratusに由来します.クラスレートという用語は、1948年にPowellにより、水素結合した水(氷)の骨格の大きなカゴの中にゲスト原子や分子を閉じ込めた物質(ハイドレート)を表すために導入されました.
Paulingらは塩素ハイドレートの結晶構造の様々なモデルを提案し(1952年)、Allenは初めてクラスレートの結晶構造を決定しました(1959年).1965年には、からなる初めての無機クラスレートが発見され、結晶構造も明らかにされました.
その後、同様の結晶構造を持つクラスレートがの14族元素の化合物において次々と発見され、無機クラスレートの一大分野が築かれました.最密充填を基本とする他の金属間化合物とは一線を画する特徴的な結晶構造から、多くの固体化学者・物理学者の興味を惹き付けました.
クラスレート(Clathrate)の結晶構造
では、クラスレートの結晶構造を見ていきましょう.塩化ナトリウム型構造や閃亜鉛鉱型構造など、最密充填を基調とする結晶構造とは大きく異なる見た目を持ちます.
ゲスト元素には、主にアルカリ金属やアルカリ土類金属が使用されます.ホスト原子としては14族原子の他、13族や15族の元素が使用される場合もあります.
下図に、最もメジャーな無機クラスレートであるⅠ型およびⅡ型クラスレートの結晶構造を示します.
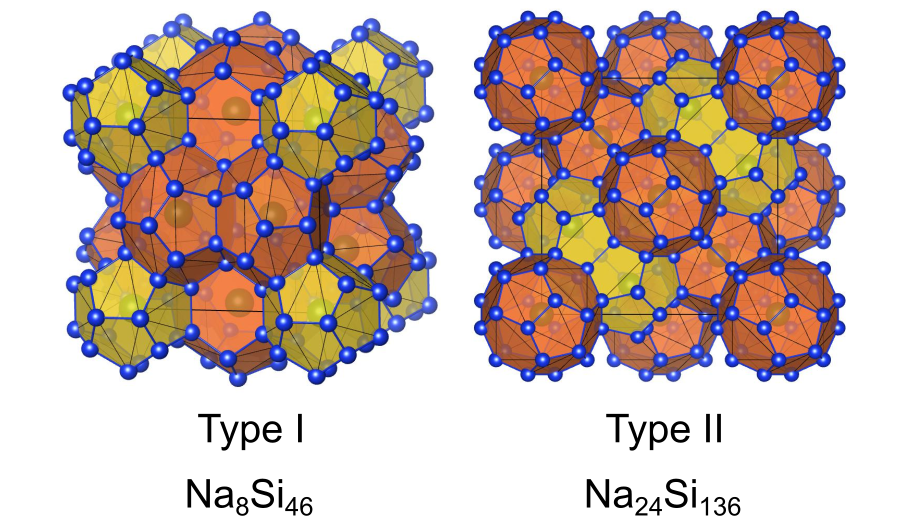
Ⅰ型クラスレートであるは、
原子20個からなる12面体と
原子24個からなる14面体から構成され、各多面体の中に
原子が配置されています.12面体は全て五角形の面、14面体は12の五角形と2つの六角形の面からなり、それぞれが面を共有して連結しています.12面体同士は隣り合っておらず、14面体を介して接続されています.
Ⅱ型クラスレートであるは、
原子20個からなる12面体と
原子28個からなる16面体から構成され、その中に
原子が内包されています.12面体は全て五角形の面、16面体は12の五角形と4つの六角形の面から構成されます.16面体は互いに六角形の面を共有してダイヤモンド構造のようなネットワークを作っています.カゴの中は常にゲストで満たされているわけではなく、カゴが空になっている部分も存在します.
いずれの構造においても、はそれぞれ4つの
と共有結合を形成しており、ダイヤモンド構造に近いネットワークを持ちます.ダイヤモンド構造と原子間距離、結合角が近い値であることから、
原子は
混成の電子状態であると考えられています.
のネットワークは炭素からなるフラーレンを彷彿とさせますが、実際にクラスレートで見られる多面体はフラーレンにおいても観測されています.
Zintl-Klemm則から考えると、や
などのゲスト原子は価電子を供与し、ホストの
や
などのホスト原子に与えます.ホスト原子が通常の14族原子に期待される4つの共有結合を形成しているので、電子が過剰にある状態です.この余った電子は伝導に寄与し、それ故クラスレートは金属伝導を示します.
一方、のような物質では、余った電子の分だけ14族の
が13族の
に置き換わっているため電子が余らず、半導体的な挙動を示します.このように、クラスレートは組成・電子数の制御を容易に行うことが可能です.
様々なクラスレート
最もメジャーなⅠ型およびⅡ型クラスレートの他にも、多くのクラスレート構造が知られています.
Ⅲ型
の組成を持つ正方晶であり、3種類の多面体から構成されています.五角形からなる正十二面体 、五角形と六角形からなる14面体、同じく五角形と六角形からなる15面体が存在し、互いに面を共有して連結しています.
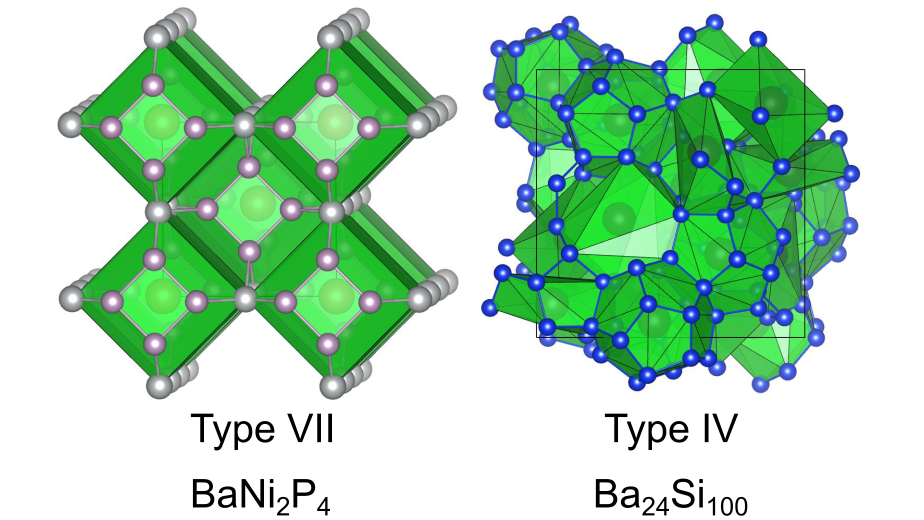
Ⅶ型
数字が飛んでⅦ型クラスレートとなります.これは頂点をカットした八面体(四角形6つと六角形8つからなる多面体)から構成されます.つまり、1種類の多面体からなる珍しいクラスレートです.
Ⅷ型
Ⅷ型では多面体が空間をすべて覆うことができておらず、厳密にはクラスレートというよりクラスレート類縁体であると考えられています.しかし、Ⅷ型はいずれも高温でⅠ型への構造相転移を示すことから、クラスレートの仲間であると認識されています.結晶構造は、23の頂点を持つ、非常に歪みの大きい12面体のみから構成されます.このような歪んだ多面体では空間をすべて埋めることができず、8頂点からなる隙間も存在します.組成は、Ⅰ型と同じくです.
Ⅸ型
Ⅷ型と同じく、多面体が空間を全て覆うことができていません.Ⅸ型では正12面体が面を共有し、螺旋状に連結しています.一般式は、で表されます.
クラスレートの人工合成
クラスレートの構造は複雑で、狙って合成するのは難しそうに思えますが、不思議なことにクラスレートは自然に形作られます.
系クラスレート発見の発端は、アルカリ金属とシリコンの化合物
の熱分解を行ったことでした.当初は
や
という組成のみが報告されましたが、その後、これらの化合物が
および
の組成を持つカゴ型物質であることが明らかにされました.
また、クラスレートが原料のよりも密度が小さいことを利用し、超高圧条件での合成も行われています.
発見から長らくの間、無機クラスレートは結晶学的な面白さだけで機能性とは無縁の存在でしたが、現在では熱電材料、超伝導体、リチウムイオン電池の電極材料など多様な応用先が有望視されています.
クラスレート(Clathrate)の機能
クラスレートは他に見られないようなユニークな構造を持っています.それゆえ、その機能性も様々で、中には応用上有用な性質も多く見出されています.
超伝導
クラスレートには金属伝導を示すものが多く見られますが、中には超伝導を示すものもあります.超伝導とは電気抵抗が厳密にゼロとなる現象で、大抵は極低温でのみ現れます.
アルカリ金属と結晶化させたフラーレンは転移温度()18 Kの超伝導体と報告されており、同様の原子ネットワークを持つクラスレートでも超伝導が起こることが期待されていました.
実際、Ⅰ型クラスレート(
= 4 K)や
(
= 3.2 K)が低温で超伝導を示すことが発見されました.超伝導には
の電子が重要な貢献をしていると予想されていましたが、実際に
量を増やした
はより高い
(8 K)を示しました.
Ⅰ型クラスレートの他にも、Ⅸ型クラスレート(
= 1.5 K)や
(
= 0.24 K)でも超伝導が発見されています.
太陽電池
太陽電池とは、太陽の光を利用して電気エネルギーを取り出す装置を表します.太陽電池には適切なバンドギャップ(1.3 eV程度)を持った半導体が必要であり、が最もよく使われます.
は資源的に豊富で安価ですが、バンドギャップが小さく(1.12 eV)、間接遷移型半導体であるので光の吸収効率が悪いという問題があります.そのため、
太陽電池は十分に厚く作る必要があり嵩張ります.
クラスレートは組成の制御によってバンドギャップが制御可能であるため、太陽電池をはじめとした半導体材料として有力です.理論計算からは、ゲストを含まないⅠ型およびⅡ型クラスレートはよりも大きなバンドギャップを持つことが示唆され、実験的にも確認されました.
Liイオン電池の負極
リチウムイオン二次電池の負極材料に求められる特性は、高い比容量、可逆的な脱挿入能、電子・
イオン伝導性、
の脱挿入時の構造安定性・小さな体積変化です.
現在、負極材料として主流のグラファイトの比容量は372 mAh/g程度ですが、は4200 mAh/gと巨大な容量を示します.しかし、
は
挿入時の体積変化が300%以上と膨大であることから実際的な応用には向きませんでした.
その点、クラスレートはを豊富に含みながらもカゴの中に大きなスペースがあり、体積膨張が小さいことが期待されます.
を挿入したⅡ型クラスレートは2012年に報告されており、クラスレートが負極材料として注目されるきっかけになりました.残念ながら
イオンの脱挿入の課程で構造が不可逆に破壊してしまい、電池の応用には向きませんでした.
Ⅰ型クラスレートについても負極材料としての研究が行われており、が顕著な構造変化を伴わずに高い容量を示すことが報告されています.クラスレートは
挿入時の体積変化が小さいなどのメリットを持ちますが、
の脱挿入機構はまだ十分に明らかにされていません.
熱電材料
温度差を電気エネルギーに変換可能な熱電材料は、排熱を有効活用できるエコなデバイスとして期待されています.熱電材料には電気をよく流すが熱をほとんど流さない物質が求められ、優れた材料は多く見つかっていますが、全ての温度範囲をカバーできるような材料は見つかっていません.
熱電材料の性能指数は下式のようにで表され、
を最大化することが求められます.
ここで、は電気伝導率、
はゼーベック係数、
は熱伝導率で、
が1を超えれば十分優れた材料と考えることができます.
Slackは、熱電材料の開発指針として、電気を結晶のように伝えるが熱がガラスのように伝えない物質(a Phonon Glass and an electron sinble crystal, PGEC)を提唱しました.PGECの候補として、原子のカゴの中に原子がガラガラのようにゆるく束縛したフレームワーク物質が挙げられ、クラスレートはまさにこの条件に適合するものでした.
実際に、が低い熱伝導率を示すことが見出され、900 Kで
の大台に達しています.
まとめ
最密充填構造が基本の金属間化合物であっても、中には複雑なネットワークを組んだ化合物が存在します.スカスカなカゴ型フレームワークからあるクラスレートはその代表で、カゴの形と連結様式によって様々なネットワークが現れます.ホストとゲストの組み合わせが豊富にあり、電子数を変えることで物性を連続的に制御することが可能になります.この特徴は実用材料を探索する上で有利で、電池・熱電・太陽電池分野での開発が進んでいます.
合成法は熱分解や高圧合成法によるものと、ややトリッキーで粉末しか得られないという問題がありましたが、近年では薄膜や単結晶試料の合成も行われています.日本でのクラスレートの研究はやや下火なような気もしますが、大いなるポテンシャルを持った材料群であり、世界的な研究は継続されています.
参考文献
材料全般
Materials Science and Engineering: R: Reports, 2016, 108: 1-46.
表面技術 2011 年 62 巻 10 号 p. 477
Journal of the Chemical Society (Resumed), 1948, 61-73.
Proceedings of the National Academy of Sciences, 1952, 38.2: 112-118.
Journal of the Chemical Society, 1959, 4131-4132.
Compt. Rend. Acad. Sci. 260 (1965) 4764.
Science 150 (1965) 1713-1714.
Journal of the American Chemical Society, 2014, 136.21: 7717-7725.
機能
Physical review letters, 1995, 74.8: 1427.
Inorganic chemistry, 2000, 39.1: 56-58.
Journal of Physics: Condensed Matter, 2005, 17.29: L311.
Physical Review B, 2005, 72.14: 144504.
IEEE Journal of Photovoltaics, 2013, 3.4: 1305-1310.
Physical Review B, 1994, 49.12: 8048.
Journal of The Electrochemical Society, 2012, 159.8: A1318.
Advanced Science, 2015, 2.6: 1500057.
CRC handbook of thermoelectrics. 1995.
Applied Physics Letters, 1998, 73.2: 178-180.
Journal of Applied Physics, 2006, 99.2: 023708.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).